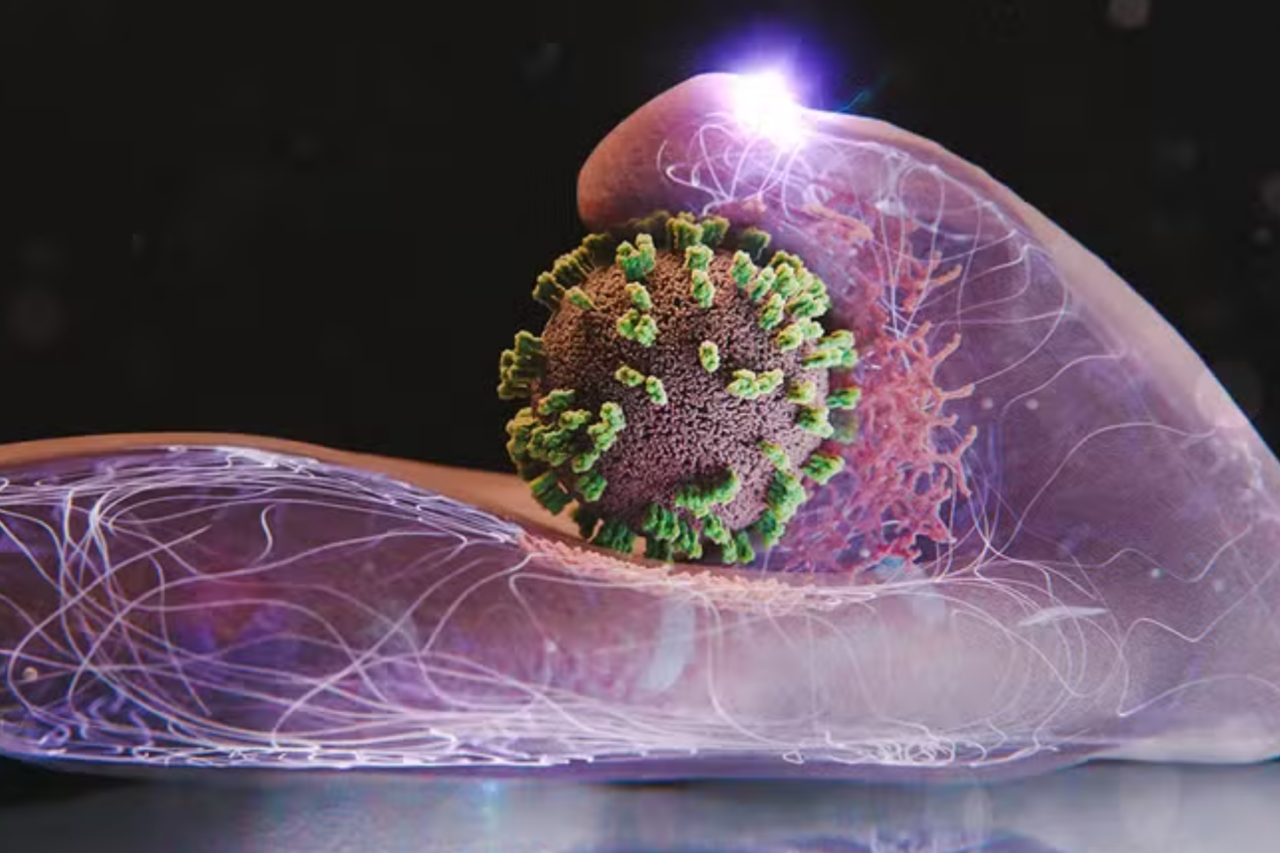
Por décadas, pesquisadores tentam decifrar em detalhes como o vírus influenza, responsável pela gripe, consegue atravessar a barreira das células humanas. Parte desse processo era conhecida, mas sempre baseada em “fotografias” isoladas, nunca em uma sequência contínua de eventos. Agora, uma colaboração entre cientistas da Suíça e do Japão conseguiu registrar, em vídeo e em alta resolução, a invasão de uma célula viva por partículas de influenza, esclarecendo etapas que até então permaneciam no campo das hipóteses.
Os resultados do trabalho foram publicados na revista científica Proceedings of the National Academy of Sciences (PNAS) e divulgados pelo Instituto Federal de Tecnologia de Zurique (ETHZ). Segundo os autores, o registro em tempo real da entrada do vírus não apenas confirma o que se suspeitava há anos, como também revela o comportamento ativo da própria célula em todo o processo de infecção.
Uma combinação inédita de microscópios
O maior desafio para observar a infecção “ao vivo” sempre foi técnico. A microscopia eletrônica oferece imagens extremamente detalhadas, mas exige a preparação e a destruição das células, impossibilitando acompanhar o movimento natural do vírus. Já a microscopia de fluorescência permite visualizar estruturas vivas, porém com resolução insuficiente para enxergar fenômenos muito pequenos, como o início da curvatura da membrana ou a formação de vesículas que englobam o microrganismo.
Para superar esse dilema, a equipe desenvolveu uma abordagem batizada de ViViD-AFM, que combina microscopia de força atômica (AFM) com microscopia confocal de fluorescência. Em termos simples, o AFM funciona como uma espécie de “agulha” nanométrica que percorre a superfície da célula, registrando cada detalhe da membrana com altíssima precisão. Ao mesmo tempo, a fluorescência marca componentes virais e proteínas celulares, permitindo identificar quem é quem na imagem.
Essa integração possibilita registrar, em tempo real, tanto a forma e as ondulações da membrana quanto o deslocamento do vírus sobre ela. Em vez de uma sequência de fotos estáticas, os cientistas passam a ter acesso a um verdadeiro “filme” da infecção.
Célula não é passiva na infecção
Uma das conclusões mais importantes do estudo é que a célula não se comporta como um alvo imóvel esperando a aproximação do vírus. As imagens mostram que a membrana celular sofre deformações constantes, formando saliências e reentrâncias enquanto tenta englobar a partícula de influenza.
Na prática, o vírus explora um mecanismo que a própria célula utiliza no dia a dia para sobreviver: a endocitose, processo pelo qual moléculas essenciais, como hormônios, colesterol e ferro, são internalizadas. Em vez de “abrir um buraco à força”, o vírus se aproveita de um sistema já existente, imitando o comportamento de um nutriente qualquer.
As filmagens em alta resolução mostram o vírus se deslocando pela superfície celular, ligando-se e se desligando de diferentes receptores, até encontrar uma região com maior concentração dessas moléculas. Nesses pontos, a célula tende a formar pequenas bolsas de membrana, que acabam servindo como porta de entrada ideal para o microrganismo.
Quando o vírus se fixa nesse “ponto ideal” da membrana, entra em cena uma proteína estrutural conhecida como clatrina. Essa molécula ajuda a moldar a membrana em forma de invaginação, criando uma espécie de depressão que vai se aprofundando até envolver completamente o vírus.
À medida que a clatrina se organiza em torno da região, a bolsa se fecha, formando uma vesícula que aprisiona a partícula viral. Em seguida, essa vesícula é destacada da superfície e transportada para o interior da célula. Uma vez lá dentro, o revestimento se desmancha e o vírus é liberado, pronto para iniciar as próximas fases da infecção e usar a maquinaria celular para se multiplicar.
Segundo os pesquisadores, todo esse processo pode ser descrito em uma sequência de etapas: primeiro, o vírus encosta na membrana e se prende a receptores específicos; depois, a célula responde formando uma bolsa ao seu redor; proteínas estruturais estabilizam essa bolsa; a membrana se curva e envolve o vírus; forma-se uma vesícula; essa vesícula é puxada para dentro da célula; por fim, o vírus é liberado no interior, onde começa a replicação.
Veja o vídeo com o passo a passo:
Superfície celular “segue” o vírus
Outro aspecto que chamou a atenção da equipe é o comportamento da membrana quando o vírus se afasta ligeiramente da superfície. As imagens mostram que as ondulações da célula aumentam de intensidade, como se ela estivesse tentando restabelecer o contato e concluir o processo de internalização. Esse tipo de interação dinâmica entre célula e vírus nunca tinha sido observado em tempo real com tamanho nível de detalhamento.
A descoberta reforça a ideia de que a infecção resulta de uma combinação de estratégias virais e respostas celulares, e não apenas de uma invasão unilateral. O vírus influenza não apenas encontra um ponto frágil, mas aprende a se aproveitar de processos fundamentais do funcionamento normal da célula.
Embora o trabalho tenha utilizado o vírus da gripe como modelo, os cientistas destacam que a técnica ViViD-AFM pode ser aplicada a outros vírus, inclusive aqueles sem relação com o influenza. Ao permitir visualizar a entrada de partículas virais em tempo real, a abordagem abre uma possibilidade importante: testar, de forma direta, se uma droga, um anticorpo ou uma formulação vacinal consegue bloquear a infecção logo nos primeiros instantes.
Na prática, isso significa que será possível observar se um antiviral impede a ligação do vírus ao receptor, interfere na curvatura da membrana ou bloqueia a formação da vesícula de internalização. Em vez de avaliar apenas o resultado final — a quantidade de vírus dentro da célula —, os pesquisadores poderão enxergar em que exato momento o tratamento interrompe o ciclo de infecção.
Os autores do estudo defendem que a nova ferramenta pode acelerar a busca por terapias contra diversos microrganismos, ajudando a compreender com mais clareza como vírus e células interagem. Ao aproximar a pesquisa básica de mecanismos de ação de medicamentos, a técnica tem potencial para influenciar tanto a virologia quanto o desenvolvimento de novas estratégias de prevenção e controle de doenças virais.
LEIA MAIS: Butantan aposta em RNA mensageiro para modernizar vacinação contra a raiva